Об отделении
В отделении хирургического лечения сложных нарушений ритма сердца и электрокардиостимузяции (ОНР) ГКБ им. И.В. Давыдовского проводятся все виды интервенционных процедур по лечению нарушений ритма сердца (желудочковые и наджелудочковые аритмии, предсердная тахикардия, трепетание и фибрилляция предсердий, предсердная и желудочковая экстрасистолия и др.); имплантации широкого спектра устройств для диагностики и лечения нарушений ритма сердца (электрокардиостимуляторы, кардиовертеры-дефибрилляторы, подкожных петлевых мониторов сердечного ритма и др.).
Мы делаем
Радиочастотная аблация аритмий сердца
Радиочастотная аблация (РЧА) – это малоинвазивное, высокоэффективное, хирургическое вмешательство в сердце, выполняемое под контролем рентгеновского оборудования. Процедура проводится с целью лечения экстрасистолии, наджелудочковых и желудочковых нарушений ритма сердца. Терапевтический эффект достигается за счет точечного воздействия на аритмогенные зоны сердца, током высокой частоты (радиочастотная энергия) с температурой 40-55 градусов или охлаждением (крио-процедура) до -80 градусов. Катетерная аблация – очень эффективный метод лечения тахиаритмий и, являясь достаточно безопасной процедурой, может навсегда устранить причину нарушения ритма сердца. В подавляющем большинстве случаев, это позволяет Вам избежать постоянного приема лекарств и вести при этом активный образ жизни.
Показания к проведению РЧА
Наджелудочковые нарушения ритма:
- атриовентрикулярная узловая реципрокная тахикардия (АВУРТ),
- атриовентрикулярная реципрокная тахикардия (АВРТ) связанная с функционированием дополнительного пути проведения (ДПП)
- предсердная тахикардия (ПТ)
- фибрилляция предсердий (ФП)
- трепетание предсердий (ТП)
- предсердная экстрасистолия
Желудочковые нарушения ритма:
- желудочковая экстрасистолия
- идиопатическая желудочковая тахикардия
- желудочковая тахикардия на фоне структурных заболеваний сердца.
Подготовка к операции: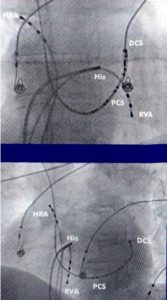
− необходимо воздержаться от приема пищи и воды в течение 6-8 часов до начала процедуры. При необходимости по согласованию с врачом Вы можете сделать несколько небольших глотков воды, если Вам надо запить лекарство (при артериальной гипертензии, сахарно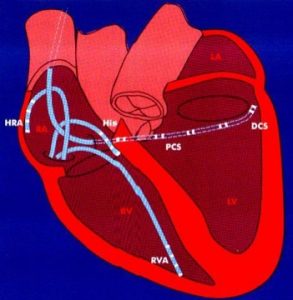 м диабете и др.);
м диабете и др.);
− за 2-3 дня до операции Вам необходимо будет прекратить прием антиаритмическихпрепаратов (по согласованию с доктором);
− обязательно скажите доктору или медсестре, если у Вас есть аллергия на лекарства.
Введение катетеров осуществляется под местной и внутривенной анестезией, как правило, в паховой области (доступ через бедренные вены), шее (доступ через ярёмную вену) или через подключичную вену.
В ходе процедуры используются специальные длинные гибкие электроды, которые могут как записывать электрическую активность сердца, так и стимулировать сердце при выполнении электрофизиологического исследования (ЭФИ). Они проводятся в сердце под рентгеноскопическим контролем.
ЭФИ – это часть процедуры, проводимая для точной диагностики нарушения ритма сердца.
Посредством стимуляции сердца доктор индуцирует аритмию и изучает её. ЭФИ помогает выявить локализацию патологических проводящих путей или эктопических очагов. Это называется «картированием». В ЭФ-лаборатории имеется все необходимое оборудование и медикаменты для изучения и купирования аритмий.
После проведения ЭФИ и идентификации очага аритмии выполняется точечная радиочастотная или крио аблация. Это приводит к формированию рубца (3-4 мм в диаметре), который не проводит электрический импульс и устраняет аритмию.
Для контроля эффективности процедуры проводится повторное ЭФИ. В случае успешного устранения аритмогенного очага — процедура завершается.
Лечение аритмии при помощи аблации является достаточно продолжительной процедурой, обычно требуется от 30 минут до несколько часов.
После окончания процедуры и извлечения электродов для предотвращения кровотечения в области пункций накладываются давящие повязки. В первые сутки, следует соблюдать постельный режим, что позволяет стабилизировать состояние пациента.
Атрио-вентрикулярная узловая реципрокная тахикардия (АВУРТ)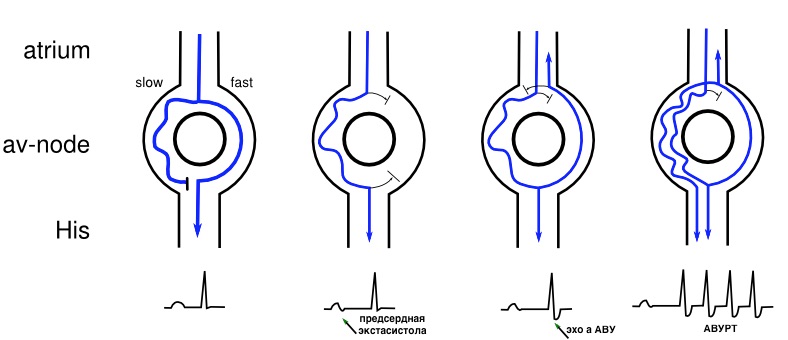
Нормальное распространение импульса от синусового узла на желудочки проходит через область атрио-вентрикулярного узла. Кольца клапанов сердца отделяют миокард предсердий от желудочков и предотвращают прямое прохождение импульса.
У пациентов с узловой тахикардией в атрио-вентрикулярном узле существуют два пути проведения — медленный и быстрый. И при определенных условиях может возникнуть ситуация, когда импульс начинает быстро крутиться внутри самого узла, а затем практически одновременно распространяться на предсердия и желудочки.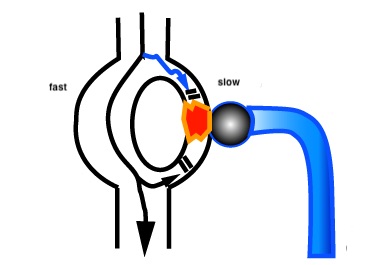
Суть операции состоит в устранении «медленного» пути проведения импульса в АВ-узле, для предовращения закручивания тахикардии. Эффективность операции 95-98%.
Синдром WPW (синдром Вольфа-Паркинсона-Уайта)
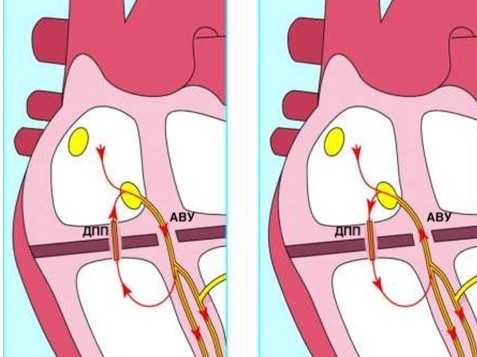 Синдром WPW — вторая по частоте встречаемости форма наджелудочковой тахикардии (после атрио-вентрикулярной узловой тахикардии). В 1930 году L.Wolff, J.Parkinson и P.White описали ЭКГ-синдром “функциональной блокады ножки пучка Гиса” и короткого интервала P-Q, который наблюдается у молодых, физически здоровых лиц, страдающих приступами тахикардий.
Синдром WPW — вторая по частоте встречаемости форма наджелудочковой тахикардии (после атрио-вентрикулярной узловой тахикардии). В 1930 году L.Wolff, J.Parkinson и P.White описали ЭКГ-синдром “функциональной блокады ножки пучка Гиса” и короткого интервала P-Q, который наблюдается у молодых, физически здоровых лиц, страдающих приступами тахикардий.
Анатомическим субстратом синдрома WPW являются дополнительные предсердно-желудочковые (атрио-вентрикулярные) соединения (ДПЖС), “пучки Кента” или, так называемые, “мышечные мостики”. Дополнительные предсердно-желудочковые соединения – это проводящие пути между миокардом предсердий и желудочков, существующие помимо структур атрио-вентрикулярного узла.
Суть операции состоит в устранении «дополнительного, аномального» пути проведения импульса в АВ-борозде.  Эффективность операции более 98%.
Эффективность операции более 98%.
Осложнения процедуры. Как и любое хирургическое вмешательство радиочастотная абляция сопряжена с определенным риском. Однако риск небольшой (менее 1%) и процедура считается относительно безопасной: у некоторых пациентов возникает кровотечение в месте введения электродов — это может стать причиной образования гематомы, в редких случаях процедура может привести к более серьезным осложнениям, связанным с повреждением стенки сердца и кровеносных сосудов. В зависимости от типа и места положения патологического проводящего пути имеется риск повреждения проводящей системы сердца. Поэтому в некоторых случаях может потребоваться имплантация кардиостимулятора. Эти осложнения являются довольно редкими и ожидаемая польза от проведения процедуры чаще всего над ними превалирует. Врачи нашего отделения делают все возможное для снижения риска осложнений.
Катетерная аблация – очень эффективный метод лечения тахиаритмий и, являясь достаточно безопасной процедурой, может навсегда устранить причину нарушения ритма сердца. В большинстве случаев, это позволяет Вам избежать постоянного приема лекарств и вести при этом активный образ жизни.
Желудочковые нарушения ритма сердца
Желудочковые нарушения ритма сердца могут быть в виде внеочередных желудочковых экстрасистол (ЖЭ) или в виде желудочковых тахикардий (ЖТ). РЧА выполняется у симптомных пациентов и, чаще всего, не зависит от количества ЖЭ и при гемодинамической стабильности пациента, имеющего ЖТ. Подготовка и операция проходит практически также, как и при наджелудочковых нарушениях ритма сердца.
Однако, эффективность процедуры РЧА напрямую зависит от локализации аритмогенного очага и от сопутствующих структурных заболеваний пациента (ишемическая болезнь сердца, клапанные пороки, кардиопатии и т.д.)
Фибрилляция предсердий
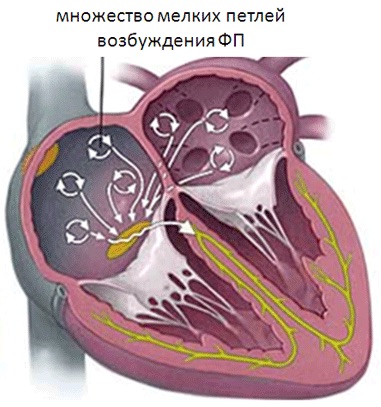 Более 3 млн. человек в России страдают самой распространенной формой тахиаритмии – мерцательной аритмией или фибрилляцией предсердий. Наряду с необходимостью частой госпитализации, вызовов бригад «скорой помощи», резкого снижения качества жизни и развития ишемических инсультов не менее чем у 40.000 пациентов в год, государство тратит огромные суммы денег, не возвращая этих больных к социально-активному образу жизни.
Более 3 млн. человек в России страдают самой распространенной формой тахиаритмии – мерцательной аритмией или фибрилляцией предсердий. Наряду с необходимостью частой госпитализации, вызовов бригад «скорой помощи», резкого снижения качества жизни и развития ишемических инсультов не менее чем у 40.000 пациентов в год, государство тратит огромные суммы денег, не возвращая этих больных к социально-активному образу жизни.
После 60 лет жизни до 6% населения страдает данным заболеванием и несмотря на постоянный прием антиаритмических препаратов и разжижающих кровь антикоагулянтов – 50-60% больных остаются симптомными и над ними висит «домоклов меч» – либо внезапной смерти, либо инвалидизации, прогрессивно увеличивающийся с момента начала заболевания.
Сегодня кардиологи и кардиохирурги, а точнее специалисты в области интервенционной аритмологии нашли новый подход к диагностике (его еще называют электрофизиологическим) и устранению так называемой пароксизмальной и ранней персистирующей формы мерцательной аритмии, когда аритмогенные очаги, запускающие аритмию, локализуются в сосудах, впадающих в левое предсердие. Используя различные системы электрофизиологической диагностики, с помощью катетерной технологии (без скальпеля) специалисты ГКБ им. И.В. Давыдовского проводят данные процедуры у ранее некурабельных больных, которые десятилетиями страдали от данной аритмии.
В настоящее время мы находимся только в начале пути использования современных технологий диагностики и лечения заболеваний сердца и аритмий с помощью так называемой «бескровной хирургии», которая не требует выполнения разрезов.
Подготовка к операции:
включает полноценное диагностическое исследование пациента – ЭКГ, ЭХОКГ, холтеровское мониторирование, анализы крови. Очень важно, чтобы пациент не менее чем за 3-4 недели до операции получал антикоагулянтную терапию (варфарин, эликвис, прадакса или ксарелто), так как операция будет выполняться в «артериальной камере» сердца. Все получаемые пациентом препараты отменяются уже в клинике, лечащим врачом. В клинике пациенту выполняется компьютерная томография и/или чреспищеводная ЭХОКГ для исключения «тромба в ушке левого предсердия. Наличие тромба является «абсолютным» противопоказанием к проведению оперативных вмешательств и требует смены антикоагулянтной терапии.
Процедура выполняется из венозного доступа (бедренные, подключичная, яремная вены). Диагностические электроды вводятся в область коронарного синуса и длинный интодюсер в полость правого предсердия. Под контролем рентгена, чреспищеводного или внутрисердечного ЭХОКГ производится пункция межпредсердной перегородки и инструменты проводятся в полость левого предсердия.
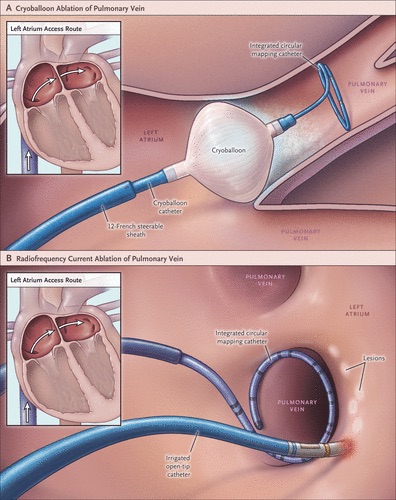
В зависимости от анатомии левого предсердия выполняется, либо Радиочастотная, либо Крио-изоляция легочных вен (ЛВ). На данный момент методики показывают равную эффективность. Выбор методики изоляции ЛВ происходит до или во время процедуры. Если пациенту до проведения операции выполнялась компьютерная томография – анатомия левого предсердия и легочных вен позволяет выбрать нужную методику (при проведении ЧПЭХОКГ до операции – во время операции выполняется ангиография левого предсердия).
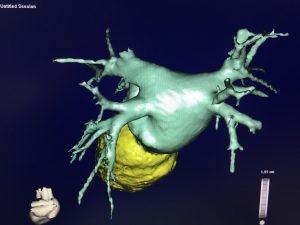
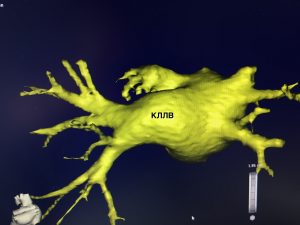
 — если левое предсердие не увеличено в размерах и легочные вены впадают в левое предсердие отдельными устьями – выбор падает на крио-изоляцию;
— если левое предсердие не увеличено в размерах и легочные вены впадают в левое предсердие отдельными устьями – выбор падает на крио-изоляцию;
— если предсердие увеличено или ЛВ имеют «коллекторный» или «вестибюлярный» вход, либо размер легочных вен более 25 мм (размер криобаллона 28 мм) выбираем радиочастотную методику изоляции.
Операция выполняется под внутривенным наркозом (пропафол, фентанил), пациент полностью не спит, но болевых ощущений не испытывает. Последовательно изолируются все легочные вены (крио- или радиочастотная деструкция), проверяется эффективность электрической изоляции и производится повторное электрофизиологическое исследование.
После окончания процедуры введение анестезиологических препаратов заканчивается, и пациент переводится на 5-6 часов (иногда дольше) в реанимационное отделение, где за ним осуществляется мониторный контроль. Затем выполняется контрольная ЭХОКГ и пациент переводится в палату под наблюдение лечащего доктора. Еще один день производится наблюдение, подбор антиаритмической и антикоагулянтной терапии – затем пациент выписывается. Пациент находится в стационаре 3-4 дня от начала госпитализации. Изменение сроков госпитализации зависит от назначений лечащего кардиолога. В послеоперационном периоде могут возникать эпизоды болей в грудной клетке, головокружения, перебои в работе сердца и приступы аритмии, связанные с проведенной операцией (отёк), которые не являются признаками «рецидива» аритмии.
Далее следует 3 месячный «слепой период», когда происходит формирование и нормализация «изоляционной линии». Это период реабилитации и, в это время, дополнительные вмешательства в сердце не производятся. Эффективность оценивается по истечении этого срока и после отмены или снижения дозировок антиаритмических препаратов.
Общая эффективность первичных процедур по изоляции легочных вен при пароксизмальных формах мерцательной аритмии составляет 65-70%. Это связано с восстановлением проведения в изолированных структурах, другими аритмиями, прогрессированием заболевания и т.д. Поэтому части пациентов (до 50%), требуется проведение повторной процедуры для выявления и устранения прорывов проведения в легочных венах или сопутствующих «внелегочных» аритмий. Эффективность вторичной операции и улучшение качества жизни достигается у 90% пациентов. Желательно, осуществлять кардиологический контроль через 3, 6 мес и через 1 год после проведения последней операции. Отмена препаратов осуществляется только лишь с согласия лечащего доктора. Часто антикоагулянтная (разжижающая) терапия остается на длительный прием и не зависит от результатов операции (высчитывается по специфической шкале CHADS2-VASc).
Количество осложнений в ГКБ им. И.В. Давыдовского составляет менее 1% и включают гемоперикард (накопление жидкости в сердечной сумке), гематомы в области пункций, парез диафрагмального нерва (только при крио-процедурах). Все осложнения эффективно устраняются в госпитальный период и могут привести к отсрочке выписки. Смертельных исходов в нашей клинике не наблюдалось.
Трепетание предсердий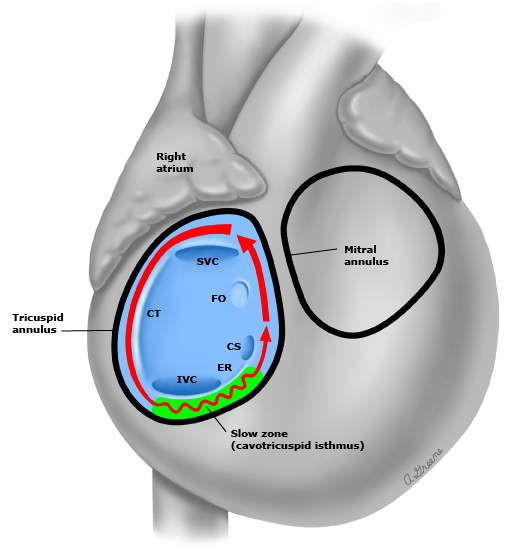
Цели ведения пациентов с трепетанием предсердий (ТП) схожи с лечением ФП. На основе имеющихся данных, риск инсульта у пациентов с трепетанием предсердий не сильно отличается от такового при ФП. Кроме того, многие пациенты с трепетанием предсердий имеют сопутствующую ФП (при такой комбинации – процедура проводится совместная). Таким образом, у пациентов с трепетанием предсердий антикоагулянтная терапия должна применяться также, как у пациентов с ФП. Контроль частоты при ТП достигается теми же лекарственными средствами, как и при ФП, но дозы препаратов как правило требуются более высокие. Типичные формы ТП имеют схожий механизм и «крутятся» вокруг трикуспидального клапана по часовой и против часовой стрелки.
Для того, чтобы эффективно устранить эту аритмию нужно провести «демаркационную» линию аблации в самом «узком» и «медленном» месте круга тахикардии – кава-трикуспидальном перешейке (от трикуспидального клапана до нижней полой вены).
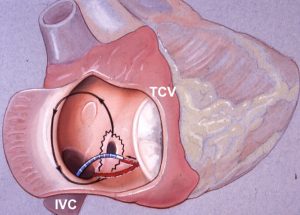
Аблация кава-трикуспидального перешейка при истмус-зависимых ТП эффективно сохраняет синусовый ритм с эффективностью 90-95%. Процедура также, как и при ФП, производиться под внутривенным наркозом, трансвенозным доступом (бедренная, подключичная, яремная вены).
Эта процедура эффективно снижает рецидивы ФП у отдельных пациентов и поможет избежать ненужных госпитализаций. Аблация перешейка является относительно безопасным и более эффективным методом, чем антиаритмическая лекарственная терапия и рекомендуется при рецидивирующем течении трепетания предсердий. Катетерная аблация левопредсердной макро-реентри тахикардии является более сложной процедурой, с более низким уровнем эффективности и высоким уровнем послеоперационных рецидивов.
Методы и технологии, которые мы используем
Имплантируемые антиаритмические устройства
В ГКБ им. И.В.Давыдовского выполняется имплантация широкого спектра устройств для диагностики и лечения нарушений ритма сердца:
- одно- и двухкамерный электрокардиостимуляторов
- одно-и двухкамерных кардиовертеров-дефибрилляторов
- кардиоресинхронизирующих электрокардиостимуляторов (CRT-P) и кардиовертеров-дефибрилляторов (CRT-D)
- подкожных петлевых мониторов сердечного ритма
- оперативная ревизия и смена всех видов имплантируемых антиаритмических устройств и электродов
- контроль и программирование всех видов имплантируемых антиаритмических устройств
Электрокардиостимулятор, или ЭКС – это небольшой имплантируемый электронный прибор, который используется при лечении пациентов с брадикардией (редким ритмом сердца) или паузами в работе сердца. Паузы и брадикардия бывают проявлениями синдрома слабости синусового узла или нарушения проводимости по сердцу (блокады). Система стимуляции состоит из двух частей: корпуса электрокардиостимулятора и одного или двух электродов, которые доставляют электрические импульсы от стимулятора к сердцу. Большинство современных ЭКС имеют размеры до 30*30 мм, толщину до 6 мм и вес до 30 грамм.
ЭКС постоянно следит за электрической активностью сердца. Если сердце работает слишком медленно, ЭКС наносит электрические импульсы, которые заставляют сердце работать с необходимой частотой. Имплантация ЭКС при редком ритме и нарушениях проводимости позволяет увеличить продолжительность жизни и улучшить ее качество за счет уменьшения выраженности или полного устранения таких симптомов, как слабость, головокружение, потемнение в глазах, эпизоды потери сознания.
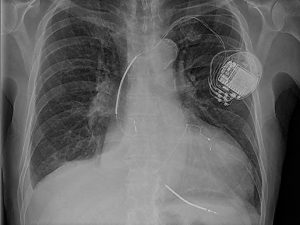 Имплантируемый кардиовертер-дефибриллятор, или ИКД – это электронное устройство, похожее на электрокардиостимулятор, но имеющее несколько бóльшие размеры: как правило толщина их не превышает 10 мм, а вес – 80 грамм. Эти аппараты используются при лечении пациентов с повышенным риском развития жизнеопасных Имплантируемый кардиовертер-дефибриллятор, или ИКДтахиаритмий – желудочковой тахикардии или фибрилляции желудочков.
Имплантируемый кардиовертер-дефибриллятор, или ИКД – это электронное устройство, похожее на электрокардиостимулятор, но имеющее несколько бóльшие размеры: как правило толщина их не превышает 10 мм, а вес – 80 грамм. Эти аппараты используются при лечении пациентов с повышенным риском развития жизнеопасных Имплантируемый кардиовертер-дефибриллятор, или ИКДтахиаритмий – желудочковой тахикардии или фибрилляции желудочков.
ИКД постоянно следит за ритмом сердца. Если развивается опасное для жизни нарушение ритма, он купируется его учащающей стимуляцией или высокоэнергетическим разрядом дефибриллятора. Разряд наносится между шоковой спиралью электрода, расположенного внутри сердца и корпусом самого аппарата. Кроме того, ИКД может работать и как электрокардиостимулятор, предупреждая развитие брадикардии и пауз в работе сердца.
ИКД используются при лечении людей, перенесших остановку сердца (клиническую смерть) или слишком частое сердцебиение (состояния, при которых сердце перестает качать кровь и происходит остановка кровообращения). Имплантация ИКД может быть показана также людям с повышенным риском остановки сердца на фоне структурного заболевания сердца.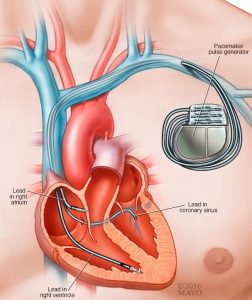
Сердечная ресинхронизирующая терапия, или СРТ – это способ лечения сердечной недостаточности в тех случаях, если она сочетается с нарушением проводимости по сердцу. В норме насосная функция сердца обеспечивается быстрым проведением электрических импульсов по так называемой проводящей системе сердца и последующим синхронным сокращением всех мышечных клеток. При сердечной недостаточности насосная функция сердца снижается в основном за счет нарушения сократительной способности кардиомиоцитов или из-за уменьшения их количества. Иногда дополнительным фактором, усугубляющим течение сердечной недостаточности, является нарушение внутрисердечной проводимости – блокада левой ножки пучка Гиса. При этом ослабленное сокращение становится еще и несогласованным – формируется внутрисердечная диссинхрония. Имплантация специализированного устройства, которое одновременно стимулирует правый и левый желудочки сердца, позволяет восстановить синхронность сокращения сердца – то есть выполнить ресинхронизацию.
Такие приборы могут быть отдельными (CRTp-кардиостимуляторы) или в составе кардиовертера-дефибриллятора (CRT-D), если пациент имеет риск внезапной сердечной смерти (ВСС).
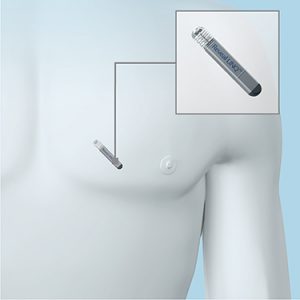
Подкожный петлевой монитор сердечного ритма – диагностический прибор, позволяющий мониторировать сердечный ритм и анализировать его в автоматическом режиме в течение длительного времени (2-3 года), а также записывать электрическую активность сердца в моменты нарушения ритма или потери сознания. Размер прибора –20*60 мм, толщина – 8 мм, вес – 15 грамм.
Имплантация ЭКС, ИКД, СРТ проводится под местной анестезией в подключичной области, обычно слева. По сосудам внутрь сердца проводятся один, два или три электрода, в зависимости от типа устройства. Антиаритмическое устройство подключается к наружным концам электродов и имплантируется в толщу подкожно-жировой клетчатки или большой грудной мышцы. Кожа ушивается внутрикожным рассасывающимся швом.
Имплантация подкожного монитора проводится под местной анестезией на передней поверхности грудной клетки слева от грудины. Подкожный монитор имплантируется под кожу. Кожа ушивается внутрикожным рассасывающимся швом.
Контроль и программирование ЭКС, ИКД, СРТ, подкожных мониторов выполняется во время госпитализации, через 1-3 месяца после операции, и затем от 1 до 4 раз в год, в зависимости от типа устройства и индивидуальной потребности пациента. При проверке лечебных антиаритмических устройств (ЭКС, ИКД, СРТ) определяются параметры работы электродов, частота срабатываний аппарата, изучаются эпизоды нарушений ритма, выполняется программирование параметров таким образом, чтобы обеспечить наиболее оптимальную и персонализированную работу устройства.







